Colegas, como vocês sabem fiz minha cirurgia e passei uma tarde e uma noite na Sala de Recuperação do HSVP. Passei muito bem pois fique sob o cuidados de três pessoas, uma à tarde (Luiz), uma das 19:00 h às 01:00 h e outra da 01:00 h às 7:00 h quando voltei a ficar sob os cuidados da equipe da manhã da qual o Luiz faz parte. Assim, nesse quesito fiquei ótimo - sem náuseas, sem tonturas, sem dor, sonolento o suficiente, sentado (30º), com um biombo me separando dos demais pacientes e com gelo colocado ao redor da face (que era efetivamente trocado a cada hora).
Mas o meu assunto nessa postagem não é esse é a analgesia pós operatória.
Durante a tarde entraram três paciente urrando de dor na SR. Perguntei para o Luiz o que estava ocorrendo e ele foi dar uma olhada. Dois pacientes não eram dos nossos cirurgiões e um era.
Tão logo esses pacientes chegaram receberam a medicação prescrita para a dor, porém continuaram se queixando. Os três tinham apenas dipirona, paracetamol (VO) e um AINES prescrito.
À noite outros dois pacientes entraram no mesmo estado, um era uma criança, que como é óbvio perturbou o sono e o repouso da grande maioria dos pacientes (alguns em coma e no ventilador talvez nem tenham percebido).
Constatado o fato, e como não tinha nada para fazer naquele momento passei a fazer algumas conjecturações, tais como:
- a condução da analgesia nas primeiras 24 horas é de nossa responsabilidade - e não da enfermagem da SR;
- como a grande maioria de nós não visitamos nossos pacientes no pós operatório ele se queixam para a enfermagem e para os cirurgiões;
- os cirurgiões, com toda razão, aporrinham o saco do primeiro que encontram, ou daquele com quem tem mais amizade;
- o diferencial de um serviço de anestesiologia é a medicina peri operatória (avaliação pré-anestésica, anestesia bem feita e cuidados pós-operatórios imediatos) que seus membros praticam.
Dessa forma como já temos a visita e a consulta pré anestésica equacionada nos resta aprimorar a anestesia (sobre a qual falarei em outra postagem) e os cuidados pós operatórios (em especial os que se referem à náuseas, vômitos, desconforto e dor pós operatória).
Acho que todos nós devemos fazer um mea culpa e reavaliar as nossas condutas.
A analgesia multimodal é seguramente a melhor nos pós-operatórios, vários trabalhos corroboram isso. Alguns desses trabalhos estão resumidos nos vários livros sobre dor aguda e analgesia pós operatória que temos no consultório (estão lá à disposição de quem se interessar).
Resumindo na analgesia multimodal a técnica consiste na associação de diversos medicamentos analgésicos ou técnicas de analgesia e co-analgesia. Os medicamentos usados são anestésicos menores (paracetamol, dipirona), um AINES, um opióide, tranquilizantes ou ansiolíticos e antieméticos.
Dentre os AINES um tem ganho destaque no pós-operatório imediato (mas que só pode ser utilizado por no máximo dois dias) que é o cetoralaco de trometamina (Toradol, Toragesic e na formulação genérica). Esse medicamento na dose de 30 mg 6/6 h tem efeito simular à 10 mg de morfina EV. Ele é mais analgésico do que os outros AINES mas tem o inconveniente de poder ser utilizado por dois dias (ANVISA). Mas ai me pergunto na dor pós-operatória qual a moral de usar AINES por mais de dois dias. O cetoralaco tem todas as contra-indicações dos demais analgésicos porém agride menos o rim e a mucosa gástrica.
O morfinomimético - especificamente a morfina - é um elemento importante nessa técnica de analgesia, porém muitas vezes ele é mal utilizado. Se não vejamos ao prescrevermos 1, 2 ou 3 mg de morfina EV de 4/4 h ou de 6/6 h deixa uma janela sem analgesia pois a sua meia-vida EV é de 1 h. Eu prescrevo morfina SC de 4/4 ou de 6/6 h, sei que muitos colegas acham que a injeção subcutânea tem uma absorção errática e é desconfortável para o paciente. Uma alternativa adequada é a infusão contínua da morfina ou do fentanil, nessa técnica temos a certeza de que o paciente mantém seus níveis séricos adequados. Lembrando sempre que os morfinomiméticos causam constipação.
Recentemente vem ganhando força na analgesia multimodal a associação desses medicamentos com bloqueios ou anestesia condutivas (infiltrativa, bloqueios periférios (tanto de MsIs quanto de MsSs), bloqueio do plexo braquial, raquianestesia, bloqueio peridural simples ou contínuo).
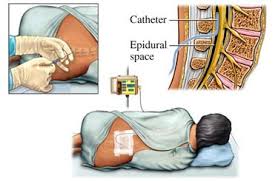
O bloqueio peridural contínuo vem sofrendo algumas restrições desde que se passou a utilizar as heparinas de baixo peso molecular. Mas trabalhos demonstram que se o cateter for passado - sem intercorrências - antes do uso dessas heparinas os riscos são mínimos. A sua retirada deve ser feita entre uma dose e outra ou seja, seis horas após a administração nos esquemas de 12/12 h e 12 horas após a administração se o esquema é de 24/24 h. Atualmente vejo indicação para o cateter epidural nas grandes cirurgia abdominais e no tratamento das fraturas da pelve e acetábulo. A solução a ser infundida depende do gosto de cada anestesista. Acredito que atualmento só o Dr. Rafael Baldissera tem feito cirurgias desse porte e o bom é que ele sabe manusear o cateter. Nas fraturas de quadril (acetábulo, anel pélvico) do Dr. Luiz Henrique temos que assumir essa função e fazer o seu manuseio no pós-operatório, principalmente a sua retirada.
Nas prostatectomias radicais, na minha opinião, basta que se faça um bloqueio subdural ou peridural com morfina ou outro opióide que permitam uma analgesia por umas doze horas.
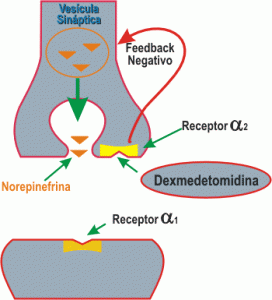
Nas cirurgias sobre o ombro ou úmero a associação da anestesia multimodal com bloqueio do plexo braquial ou cervical é imperativa. Eu tenho uma técnica que aprendi num work shop em que o plexo braquial é abordado via posterior. É muito fácil de fazer, os aspectos negativos são, o paciente deve estar sentado ou ser colocado em decúbito lateral sobre o lado são. Breve postarei a técnica que eu uso. Em alguns casos em que não consigo fazer o bloqueio deixo o paciente com infusão contínua de dexmedetomidina associada a analgesia multimodal (com parcimônia no uso dos opióides).
Nas
cirurgias sobre o membro superior é claro que a associação perfeita é o bloqueio de plexo braquial com a analgesia multimodal. Muitas vezes pela premência de tempo ou dificuldades técnicas não conseguimos fazer o bloqueio. Nesse caso a solução é: ao final da cirurgia solicitar a infiltração do local da cirurgia ou um bloqueio mais periférico seja feito pelo cirurgião.
Dr. Antonio Severo bloqueando paciente
Nos pacientes em que opto por anestesia geral solicito aos cirurgião que
infiltre o local com ropivacaína ou bupivacaína, associada ou não à clonidina. Todos os cirurgiões concordam com essa técnica, alguns até, além da infiltração local, fazem um bloqueio periférico.
Nas
cirurgias sobre o quadril temos o grande dilema de usar ou não a analgesia peridural contínua. Eu não tenho usado. Tenho feito via de regra uma raquianestesia com morfina e mantenho a anestesia multimodal no pós-operatório. Nas próximas cirurgias vou visitar os paciente para ver se funciona.
Nas cirurgias sobre o joelho tenho duas técnicas de analgesia (associada à multimodal).
Nas
videoartroscopias faço uma anestesia geral endovenosa sob máscara laríngea e solicito que ao fina o joelho seja infiltrado com ropivacaína 10 mg/ml + morfina 10 mg. Utilizo a ropivacaína pois na grande maioria das vezes ao o cirurgião ao usar o
shaver cria uma área cruenta podendo causar a absorção do anestésico local e nesse caso a ropivacaína é a que tem menor toxicidade.
Para as
próteses de joelho ou as cirurgias que envolvem o reparo do ligamento colateral anterior (ou outro qualquer) a minha opção é pelo bloqueio peridural ou raquianestesia (com sedação) e depois o
bloqueio do nervo femoral. Esse bloqueio pode ser feito antes do paciente sair da sala ou horas após já na recuperação. Para esse bloqueio utilizo ropivacaína 10 mg/ml 20 ml associada à clonidina 150 mcg. E é claro a analgesia multimodal. Tem dado certo.
Para as
cirurgias sobre o pé ou antepé algumas vezes faço bloqueio central em outras anestesia geral e o Dr. Everton infiltra o local (além de fazer bloqueios distais) com ropivacaína isso tem funcionado bem. No pós operatório imediato a analgesia multimodal é a minha escolha.
Nisso tudo o que importa é o bem estar do paciente e para isso temos que deixar de lado as técnicas ultrapassadas, nos interessarmos mais pelos nossos pacientes e
deixar o comodismo de lado.
Abraços,
Lorenzini
P.S.: Próxima postagem "Dexmedetomidina - uma boa opção para o trans e pós operatório"